时间:08-15 16:38
时间:08-15 09:08
时间:08-15 08:59
时间:08-15 08:33
中商情报网讯:透明质,又名玻尿酸,是一种酸性粘多糖,透明质酸以其独特的分子结构和理化性质在机体内显示出多种重要的生理功能,如润滑关节,调节血管壁的通透性,调节蛋白质,水电解质扩散及运转,促进创伤愈合等。
市场规模
根据Frost&Sullivan数据显示,2019年,全球透明质酸原料市场销量达到580吨,2016-2019复合增速约为20%,增长的驱动力主要为下游应用行业的需求大幅增长、以及透明质酸制造工艺的不断突破。展望未来,2019-2024E年行业的复合增速预计为14.7%,在2021年达到620吨的市场销量。
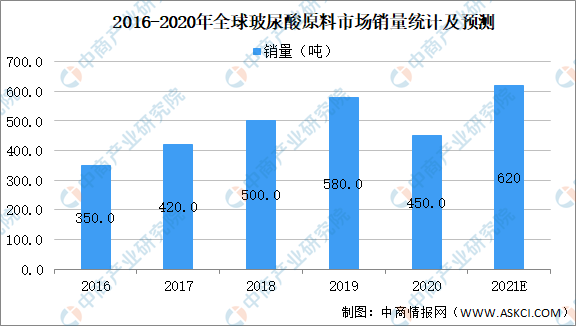
数据来源:Frost&Sullivan、中商产业研究院整理
应用占比
食品级玻尿酸主要用于各种营养补充食品、保健品中,在欧美发达国家普及度较高。化妆品级玻尿酸主要用于各种保湿类护肤品、彩妆以及日化产品中,对蛋白质含量有严格控制。医药级玻尿酸对于质量控制最为严格,企业在生产医药级玻尿酸时,需要经过GMP(药品生产质量管理规范)的质量审核和稳定性考察,还需要药厂生产许可证、药品批准文号等,整个过程一般需要2-5年。但是另一方面,从售价和盈利能力来看,医药级产品也明显高于其他品类。
数据显示,2016-2020年全球玻尿酸原料市场销量中占比最大的为化妆品级玻尿酸、其次为食品级玻尿酸,最后为医药级玻尿酸。
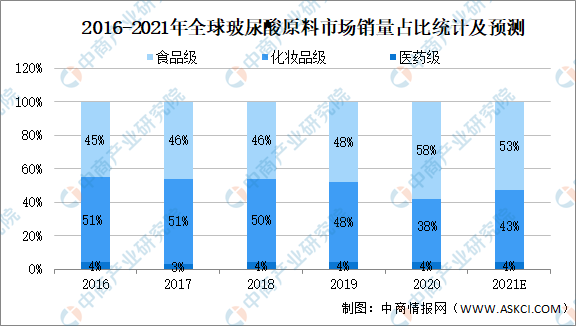
数据来源:Frost&Sullivan、中商产业研究院整理
行业监管政策变动情况
1.CFDA进一步加强对透明质酸类产品的监管
新版《医疗器械分类目录》细化了医疗器械产品具体的管理类别,进一步规范了透明质酸类产品的分类及管理,提高了透明质酸类产品的注册门槛,对透明质酸类产品的生产企业提出了更高的要求。根据新版《医疗器械分类目录》,目前公司透明质酸终端产品的分类未发生变化,新版《医疗器械分类目录》不会对公司目前的生产经营造成影响。对于新开发透明质酸类产品,公司将严格按照新版《医疗器械分类目录》的要求进行研发和注册。
2.欧盟医疗器材法规(MDR)将生效实施
新法规大幅提升有关医材认证的规范与限制,增加医材追溯性、临床试验规范严谨度、临床证据的掌握度,增加上市后的产品安全性与效能监督。MDR施行后,生物医用材料新品需严格按照新规进行认证;此前依照MDD及AIMD指令取得的认证证书将于2024年失效,因此已获得认证的产品后续仍需重新申请CE认证,且必须开始收集自身产品于PMCF(上市后临床跟踪指南)的临床监督证据。
MDR对生物医用材料的产品质量要求显著提高,产品制造商需要对其销往欧盟市场的产品进行全面审查,以确定与MDR新规在分类、技术文档、标签和一般安全和性能要求(包括支持临床证据)等方面的合规差距,并采取应对措施以确保产品CE认证的有效性。
3.原材料与制剂共同审评审批的政策变化影响
新药及仿制药研发需要投入大量的时间和成本,产品审评进度延误或被否会对制剂企业造成经济损失。关联审批实施后,药品原辅料的工艺质量研究水平和资料完善程度影响制剂的审评进度,因而制剂企业在新药及仿制药研发过程中,会主动对所涉及的原辅料及其生产企业开展充分的风险评估。为避免因原辅料问题造成的审批不确定性,制剂研发企业通常更倾向于选用“已激活”状态的原辅料或此前已取得注册号的原辅料进行关联审批。未来,如同类型的原料药/药用辅料企业通过关联审批并进入“已激活”状态,并随着企业数量的增加,可能会对发行人医药级原料的销售业务造成不利影响。
更多资料请参考中商产业研究院发布的《中国玻尿酸行业市场前景及投资机会研究报告》,同时中商产业研究院还提供产业大数据、产业情报、产业研究报告、产业规划、园区规划、十四五规划、产业招商引资等服务。
时间:08-15 16:38
时间:08-15 09:08
时间:08-15 08:59
时间:08-15 08:33