时间:07-26 11:25
时间:07-26 11:20
时间:07-26 11:14
时间:07-26 11:07
中商情报网讯:IND是InvestigationalNewDrug的缩写,是指新药临床研究审批,新药的产生需要进行两次行政审批,一是在临床研究阶段(IND申报),二是临床研究完成注册上市(NDA申报)。自从国家鼓励新药创制以来,无论是政策、法规、还是指南,其更新和迭代速度大大提升,为创新药的研发提供了大量的理论支撑。如IND阶段相关的《新药I期临床试验申请技术指南》、《化学药品创新药I期临床试验申请药学共性问题相关技术要求》、《化学药品I期临床试验申请药学研究信息汇总表》等。
在持续的高研发投入下,中国国产药物的IND数量迅速上市,国内开展的临床试验数量也大幅增加。2018年之后,中国首次IND新药数量快速上升,近3年总体年均复合增长率为47%,其中,国产创新药首次IND新药数量增长显著高于进口创新药,2021年国产药品占比达76%,化药和生物药均保持高速增长。2021年,新兴疗法如PROTAC、三抗/四抗、CAR-NK、肿瘤浸润淋巴细胞(TIL)等首次在中国IND,总数达644款。
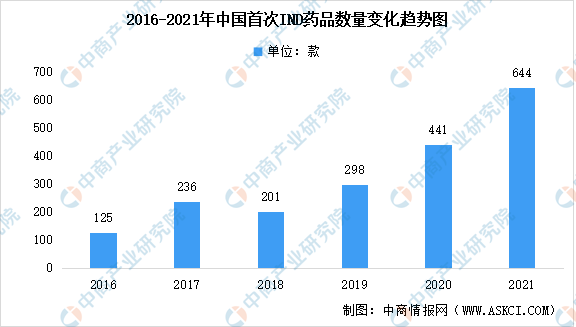
数据来源:医药魔方、中商产业研究院整理
对于I期临床试验申请,为了保障受试者的安全,药学审评通常重点关注与安全性相关的问题,例如杂质、稳定性、无菌制剂生产条件和除菌/灭菌方法、以及临床前动物安全性评价试验与后续人体临床试验所用样品的质量可比性等。数据显示,2017年之后,临床登记数量也迅速增长,2021年临床登记数量达1490个,同比增长接近50%。从2016年到2021年的临床试验数量的年复合增长率达到35%。
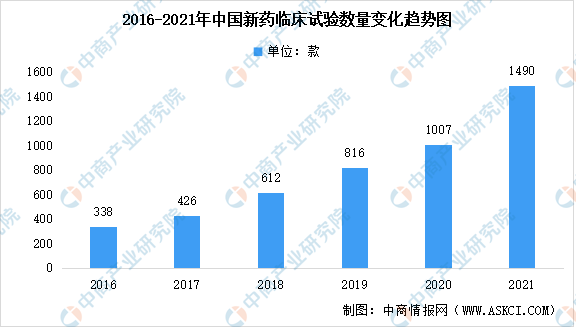
数据来源:医药魔方、中商产业研究院整理
更多资料请参考中商产业研究院发布的《中国医药行业市场前景及投资机会研究报告》,同时中商产业研究院还提供产业大数据、产业情报、产业研究报告、产业规划、园区规划、十四五规划、产业招商引资等服务。
时间:07-26 11:25
时间:07-26 11:20
时间:07-26 11:14
时间:07-26 11:07