中商产业研究院2020-08-06
中商情报网讯:北京贝尔生物工程股份有限公司首次公开发行股票并在创业板上市。据了解,北京贝尔生物工程股份有限公司主要从事专业研发、生产及销售体外诊断试剂及配套仪器,产品覆盖呼吸道、优生优育、传染病、EB病毒、手足口、肝炎、肿瘤、肝纤维化、高血压、糖尿病、甲状腺功能、生殖内分泌、自身抗体等多个检测领域。
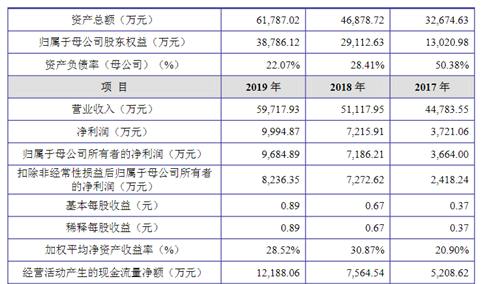
主要财务指标
北京贝尔生物工程股份有限公司资产总额和净利润逐年增加,2017年度资产总额为29,584.35万元,2018年度资产总额为34,916.67万元,2019年资产总额为38,143.91万元;2017年度净利润为761,58万元,2018年度净利润为3,497.30万元,2019年度净利润为6,155.79万元。
主要财务指标表
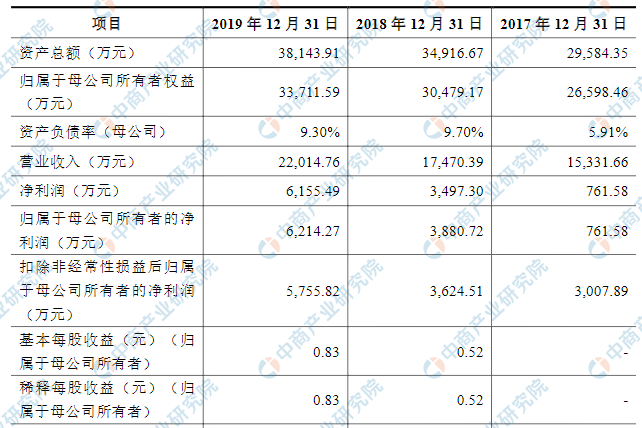
资料来源:中商产业研究院整理
本次上市存在的风险
(一)行业竞争加剧的风险
体外诊断行业作为国家产业结构调整指导中鼓励发展的行业以及战略性新兴产业,未来仍将保持快速增长,因而不断有新竞争者加入。国外企业依靠产品质量稳定、技术含量高以及高效、精确的仪器配套,在体外诊断行业中占据了较高的市场份额,在国内三级医院的高端市场占据垄断地位。
国内企业随着研发、生产及管理水平的不断提高,部分企业的产品质量已经达到国际先进水平,国产产品的市场份额正在不断扩大,市场逐步向龙头企业集中,行业集中度不断提高。如果公司未来不能在研发投入、技术储备、产品布局、销售渠道和服务能力等方面继续保持一定的优势,将会面临增长放缓、市场份额下降以及盈利能力下降的风险。
(二)“两票制”政策实施的风险
2016年4月国务院颁布《深化医药卫生体制改革2016年重点工作任务》,对深化医药卫生体制改革提出了包括“加快推进分级诊疗制度建设”、“优化药品购销秩序,压缩流通环节,综合医改试点省份要在全省范围内推行‘两票制’,积极鼓励公立医院综合改革试点城市推行‘两票制’,鼓励医院与药品生产企业直接结算药品货款、药品生产企业与配送企业结算配送费用,压缩中间环节,降低虚高价格”等具体改革措施。
2016年12月国务院医改办、国家卫计委等多部门联合印发《关于在公立医疗机构药品采购中推行“两票制”的实施意见(试行)》,要求逐步推行公立医疗机构药品采购“两票制”,鼓励其他医疗机构推行“两票制”,减少药品流通领域中间环节,提高流通企业集中度。
2018年3月,国家卫健委、财政部、国家发改委、人社部、国家中医药管理局、国务院医改办联合发布《关于巩固破除以药补医成果持续深化公立医院综合改革的通知》,明确提出要持续深化药品耗材领域改革,实行高值医用耗材分类集中采购,逐步推行高值医用耗材购销“两票制”。
目前,“两票制”政策主要针对药品及高值医用耗材,体外诊断试剂及配套仪器不属于药品及高值医用耗材。但在药品及高值医用耗材“两票制”政策逐步推进的背景下,也有部分省市和地区对全部耗材包括检测试剂实施“两票制”政策。自2016年起,已先后有多个省份及地区开始对检测试剂实行“两票制”,预计检测试剂领域后续存在“两票制”推行扩大的可能。“两票制”的推行将进一步规范流通市场秩序,对公司的市场服务能力、营销网络建设以及管理水平都提出了更高的要求,如果公司不能很好地适应政策变化,可能存在公司市场份额下降和经营业绩下滑的风险。
(三)新产品研发和注册风险
体外诊断行业为技术密集型行业,能否通过研发不断提升现有产品质量及开发更符合市场需求的新产品,是公司能否在行业中保持领先地位并不断扩大产品及市场优势的关键因素之一。一项新产品的研发需要经过临床前研究、临床研究和注册审批等阶段后才能取得国家药品监督管理部门颁发的产品注册证书,正式投入生产并上市销售。诊断试剂产品的研发和注册周期一般为3-5年。如果公司不能成功、及时地开发出新产品并通过注册,将会导致新产品的研发或注册失败,从而影响公司前期研发投入回报和未来收益的实现。
(四)原材料供应和价格波动的风险
公司主要原材料包括活性原料、化学试剂、机加工部件及电子元器件等。报告期内,公司营业成本中直接材料的比例分别为83.43%、83.27%和82.50%,主要原材料对公司的营业成本构成重大影响。报告期内公司经营规模不断增长,公司对上述原材料的需求不断增加,如果未来相关供应商无法满足公司快速增长的原材料需求,可能导致公司无法获取稳定的供应来源,从而对公司的业务和经营业绩造成不利影响。此外,如果主要原材料的市场价格大幅上涨,亦将对公司的盈利情况造成一定的不利影响。
(五)现有主要生产经营场所未取得土地及房屋产权证的风险
公司现有主要生产经营场所位于北京市大兴区黄村镇芦城工业开发区创新路99号,约10亩土地。截至2019年12月31日,上述土地未记录账面价值,上述房屋建筑物账面价值为1,664.71万元。由于历史遗留问题、相关建设施工手续不全、未批先建等原因,公司目前尚未取得土地使用权及房屋所有权证书,并因此受到了北京市国土资源局、北京市大兴区生态环境局的行政处罚。
目前,发行人已依据《中华人民共和国土地管理法》、《中华人民共和国土地管理法实施条例》、《北京市建设征地补偿安置办法》等法律法规的要求履行了建设工程规划用地测量、签订《征地补偿安置协议》等程序,并与北京市大兴区黄村镇人民政府和北京市规划和国土资源管理委员会大兴分局协同,积极办理了项目建设相关前置手续,待取得北京市政府批准后即可办理相应土地的征地、出让以及相关土地及房屋产权证的办理工作。
公司目前可以正常使用该等土地及房屋,该等土地及房屋未取得权属证书的情形目前未对公司生产经营和财务状况产生重大不利影响,但公司仍存在未来无法及时取得现有生产经营场所的土地及房屋产权证书并被要求搬迁的风险。
(六)“联动销售”模式下仪器的管理风险
为巩固合作关系及促进销售,公司现有部分仪器采取“联动销售”的业务模式,由公司将仪器提供给经销商,经销商向终端医疗机构进行投放,该部分仪器从后续试剂销售盈利中收回成本、赚取利润。
公司拥有仪器的所有权,经销商与医疗机构拥有仪器的使用权,公司与经销商共同进行仪器维护。该经营模式是目前体外诊断行业内通行的经营模式。截至2019年12月31日,公司“联动销售”模式下在终端客户投放的全自动酶免仪共35台、酶标仪及洗板机共14台、胶体金试纸分析仪共3,985台、全自动化学发光免疫分析仪共163台。
针对该部分仪器,公司建立了较为完善的管理制度,销售人员会定期或不定期去往仪器投放的终端医疗机构进行设备检查及盘点。虽然公司约定了经销商对仪器妥善保管及损坏赔偿的义务,但由于仪器最终由终端医疗机构使用,仍存在因终端医疗机构使用不善或经销商未严格履行保管义务而导致仪器损毁或灭失的风险。
(七)商誉减值风险
截至2019年12月31日,公司商誉的账面价值为2,310.85万元,系公司于2017年度收购赛维生物控股权构成非同一控制下的企业合并形成,合并时点确认的商誉原值为6,299.98万元。赛维生物主要从事全自动化学发光免疫分析仪及配套试剂的研发、生产和销售。
公司于每年末对商誉进行减值测试,并聘请专业评估机构出具评估报告。公司分别于2017年度及2018年度计提了商誉减值准备3,056.12万元及933.02万元。2019年度,随着产品推广及市场培育的日趋成熟,赛维生物生产的全自动化学发光免疫分析仪及配套试剂的市场占有率有明显提高,完成了2019年度的业绩预期。结合专业评估机构出具的评估结果,公司未对商誉进行减值准备的计提。若赛维生物未来由于宏观经济或市场环境发生重大不利变化等原因导致经营业绩未达到预期,致使其可收回金额低于其账面价值,则相关商誉存在进一步减值的风险,从而会对公司业绩造成不利影响。
(八)产品市场拓展的风险
公司本次发行募集资金项目主要围绕体外诊断行业,全部项目达产后可形成具备年产6,250.00万人份化学发光诊断试剂、年产3,700.00万人份酶联免疫和胶体金诊断试剂、年产526台全自动化学发光免疫分析仪的生产能力,将有助于公司经营业绩的进一步提升,巩固并加强公司的竞争优势。尽管公司已结合报告期内产品销量增长情况以及新产品市场需求对募集资金投资项目的市场前景进行了充分的可行性分析,并制定了完善的市场开拓计划,但如果未来市场环境出现较大变化,或者出现其它对产品销售不利的客观因素,将可能导致募集资金投资项目新增产能难以消化,产生无法实现预期盈利目标的风险。
(九)新型冠状病毒肺炎疫情对公司生产经营影响的风险
2020年1月我国爆发新型冠状病毒肺炎疫情(以下简称“新冠疫情”、“疫情”),各省市地方政府执行严格的新冠疫情防控措施,2020年一季度我国企业复工复产受到一定不利影响。
公司主营业务和产品与生命健康紧密相关,虽然受新冠疫情的影响,公司的客户和供应商复工时间有一定程度的延迟,终端医疗机构检测量短期内有所下降,但体外诊断行业刚性需求较强的特点未发生变化。公司于2020年1月29日开始逐步复工复产,经营活动在较短时间内即恢复正常,本次疫情对公司的影响具体如下:
1、采购方面公司主要原材料供应商为国内企业,集中于北京及长三角地区,因疫情期间复工较晚及交通运输管控等原因,部分供应商供货时间延长。
对于活性原料等公司生产需要的关键原材料,公司历来均设置了较高的安全库存,在新冠疫情爆发前进行了较为充足的备货,采购周期的延长未对公司生产经营产生重大影响。
2、生产方面公司于2020年1月29日开始逐步复工,复工后因下游需求短暂性减少,因此在复工初期公司适当调整生产计划并减少产量。未来随着下游检测需求的持续恢复,公司的产能利用率将逐步回升至正常水平,疫情对公司生产影响较小。
3、销售方面公司产品以内销为主,因疫情防控期间各地限制人员流动,公司终端客户各级医院及检测机构除新冠病人外,其他疾病就诊人数大幅减少,导致公司2020年第一季度销售收入同比降低约30%。第二季度开始,国内逐步复工复产,终端检测需求逐渐恢复正常,公司的产能利用率及销售情况均持续好转。另一方面,作为专业研发体外诊断试剂及配套仪器的高新技术企业,公司于疫情发生后第一时间开始进行新冠病毒检测试剂盒的研发工作。
截至招股说明书签署日,公司已成功完成5种新冠病毒检测试剂盒的研发(磁微粒化学发光法抗体检测试剂盒2种、胶体金法抗体检测试剂盒2种、核酸检测试剂盒1种),其中磁微粒化学发光抗体检测试剂盒及胶体金法抗体检测试剂盒已完成注册检验工作并进入国家药监局注册评审阶段;核酸检测试剂盒已完成注册检验,正处于临床实验阶段。
另外,公司的2款胶体金法抗体检测试剂盒已于2020年4月20日取得欧盟CE认证。基于上述产品的注册申报进度,公司未来将积极参与到新冠疫情的防控工作中,为国内外医疗机构提供具有价格竞争力且质量优秀的新冠病毒检测试剂盒产品。综上,新冠疫情对公司在采购、生产及销售方面的不利影响是阶段性的。
但现阶段海外新冠疫情传播尚未得到有效控制,国内疫情也存在再次爆发的风险,若未来短时间内仍不能有效抑制或再次发生疫情大规模爆发的情况,导致国内(包括公司的生产经营所在地)再次实施较为严格的疫情防控措施,则公司业务将受到一定程度的不利影响。